
基因编辑技术帮助人们实现了“编辑生命”的愿望,但该技术自身存在的局限性也限制了其广泛应用,此前人们的研究热情也多集中在编辑的效率、准确性与安全性,但常规的基因编辑技术在一个反应中仅能对一个或数个基因进行操作,且通常会在基因组中留下额外的不需要的序列修改,在大型研究中,已有的基因编辑技术远远无法满足大量不同基因的编辑需求。
为解决上述问题,哈佛大学George Church教授领导的研究团队开发了一种基于CRISPR-Cas9的新型高通量基因编辑方法:guide+donor,该方法可以在单个酿酒酵母中同时精确改变数百个不同基因,编辑效率达到80%至100%,还能在生物体内选择特定行为细胞,进行定向基因编辑和修复。guide+donor除帮助构建大型文库外,还能进行基因功能分析,发现一些未知的基因突变和功能。
5月21日,相关研究成果发表在著名学术期刊Nature Biotechnology上,文章题为“High-throughput creation and functional profiling of DNA sequence variant libraries using CRISPR–Cas9 in yeast”。


George Church教授
人类的基因变异通常是点突变导致,为在不干扰其他潜在变异的情况下重构酿酒酵母中的某些变异,CRISPR-Cas9技术借助sgRNA精确靶向DNA目标序列,在Cas9酶切割其靶序列后,在一个被称为同源定向重组(HDR)的过程中,借助携带目的基因突变的供体模板序列来修复基因。
研究人员表示,新的研发策略是将sgRNA、供体模板序列与一个稳定可遗传的染色体外DNA分子连接起来,组成guide+donor组合,这能在一个反应中构建大型变体文库,同时将多个sgRNAs和供体模板大量传递到酵母细胞,还能定向修复断裂的DNA双链,并通过NGS技术识别被编辑的细胞。
技术优势:
在一个反应中快速构建大型DNA变异文库
在一个反应中同时提供guide和donor,防止无效修复和非生产性修复。
含有guide+donor组合的质粒可以作为追踪基因编辑细胞的独特条形码,利用NGS技术可以进行高通量分子表型鉴定。

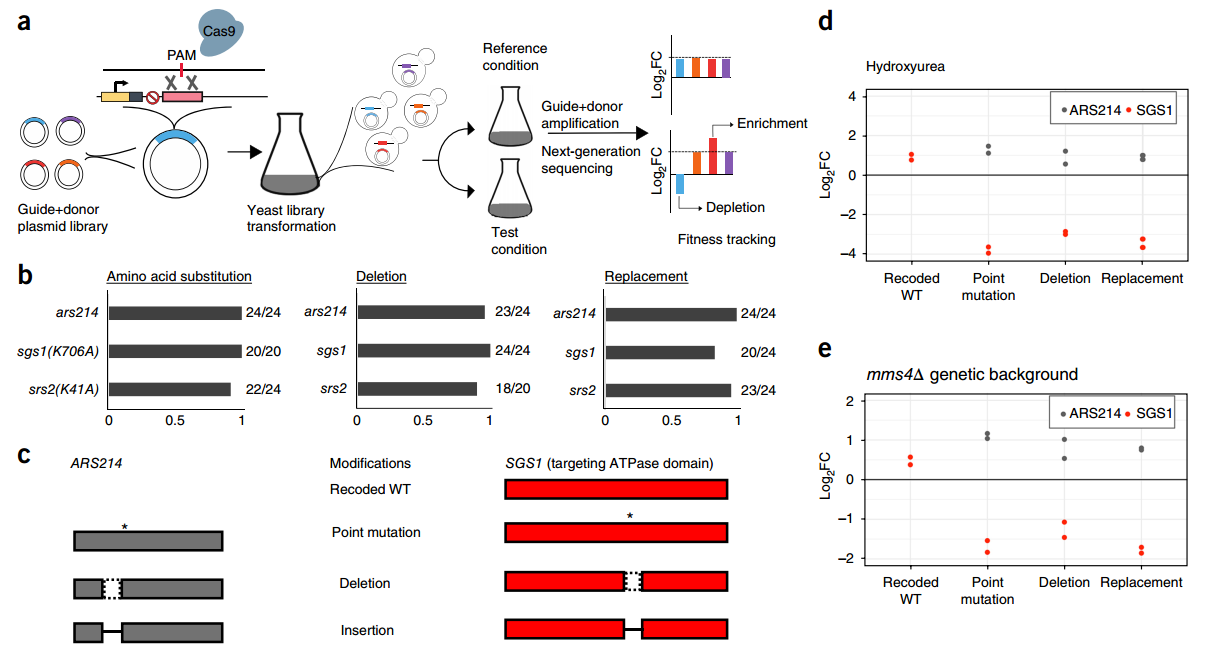
guide+donor基因组编辑平台,来源:Nature Biotechnology
在证明过程中,该团队首先关注了酵母中编码DNA解旋酶和修复酶SGS1的单个高保守基因序列,然后他们用一种有毒试剂破坏了携带guide+donor文库的酵母细胞DNA,然后对存活细胞进行DNA测序。最终他们发现了影响SGS1特征的基因突变,这些特征对于受损DNA的修复至关重要,并且能影响细胞持续存活。
随后,该研究团队使用guide+donor方法剔除了酵母全基因组中的315个基因,它们可以编码分散在整个基因组中的小型开放阅读框架(smORF,长度<100个氨基酸)。
在检测的315个smORF中,研究人员发现68个是在细胞适应性存活中起重要作用,这与传统ORFs功能认知相反,因为在相同条件下,307个ORF中的104个会参与细胞生长。通过分析这些基因对酵母在不同胁迫环境下存活的影响,发现可以将未明确的基本功能分配到特定的smORF,为基因功能分析打开了新的大门。
Church表示,新的方法不仅能够更高效、更准确地在酵母中进行高通量“功能基因组学”研究,还能模拟、检测酵母细胞中与特定性状或功能紊乱相关的低频基因突变,并找出哪些与疾病实际相关。此外,该方法除了可以在庞大的基因家族中挖掘新的基因和功能外,还能研究基因组中的非编码序列,提高我们对基因调控和染色体生物学的理解。
参考文献:
1.Profiling the genome hundreds of variations at a time
2.High-throughput creation and functional profiling of DNA sequence variant libraries using CRISPR–Cas9 in yeast
转自:测序中国